某省原料药GMP检查要点(DOC 32页)
某省原料药GMP检查要点(DOC 32页)内容简介
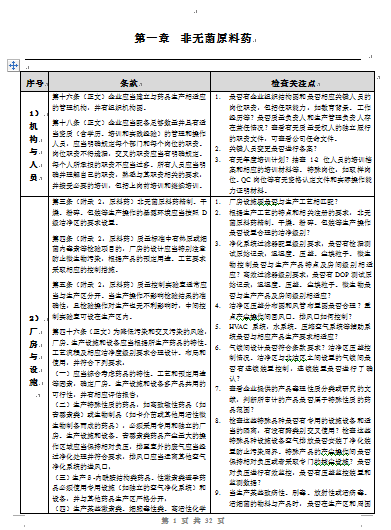
第十六条(正文)企业应当建立与药品生产相适应的管理机构,并有组织机构图。
第十八条(正文)企业应当配备足够数量并具有适当资质(含学历、培训和实践经验)
的管理和操作人员,应当明确规定每个部门和每个岗位的职责。岗位职责不得遗漏,
交叉的职责应当有明确规定。每个人所承担的职责不应当过多。所有人员应当明确并理解自己的职责,
熟悉与其职责相关的要求,并接受必要的培训,包括上岗前培训和继续培训。
第三条(附录2:原料药)非无菌原料药精制、干燥、粉碎、
包装等生产操作的暴露环境应当按照D级洁净区的要求设置。
第四条(附录2:原料药)质量标准中有热原或细菌内毒素等检验项目的,
厂房的设计应当特别注意防止微生物污染,根据产品的预定用途、工艺要求采取相应的控制措施。
第五条(附录2:原料药)质量控制实验室通常应当与生产区分开。
当生产操作不影响检验结果的准确性,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
第四十六条(正文)为降低污染和交叉污染的风险,厂房、
生产设施和设备应当根据所生产药品的特性、
工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求:
(一)应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、
生产设施和设备多产品共用的可行性,并有相应评估报告;
..............................
第十八条(正文)企业应当配备足够数量并具有适当资质(含学历、培训和实践经验)
的管理和操作人员,应当明确规定每个部门和每个岗位的职责。岗位职责不得遗漏,
交叉的职责应当有明确规定。每个人所承担的职责不应当过多。所有人员应当明确并理解自己的职责,
熟悉与其职责相关的要求,并接受必要的培训,包括上岗前培训和继续培训。
第三条(附录2:原料药)非无菌原料药精制、干燥、粉碎、
包装等生产操作的暴露环境应当按照D级洁净区的要求设置。
第四条(附录2:原料药)质量标准中有热原或细菌内毒素等检验项目的,
厂房的设计应当特别注意防止微生物污染,根据产品的预定用途、工艺要求采取相应的控制措施。
第五条(附录2:原料药)质量控制实验室通常应当与生产区分开。
当生产操作不影响检验结果的准确性,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
第四十六条(正文)为降低污染和交叉污染的风险,厂房、
生产设施和设备应当根据所生产药品的特性、
工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求:
(一)应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、
生产设施和设备多产品共用的可行性,并有相应评估报告;
..............................

用户登陆
医疗药品管理热门资料
医疗药品管理相关下载